IPTG (izopropil-β-D-tiogalactozida) este un analog al substratului β-galactozidazei, care este foarte inductibil.Sub inducerea IPTG, inductorul poate forma un complex cu proteina represoare, astfel încât conformația proteinei represoare este schimbată, astfel încât nu poate fi combinată cu gena țintă, iar gena țintă este exprimată eficient.Deci, cum ar trebui să fie determinată concentrația de IPTG în timpul experimentului?Cu cât este mai mare, cu atât mai bine?
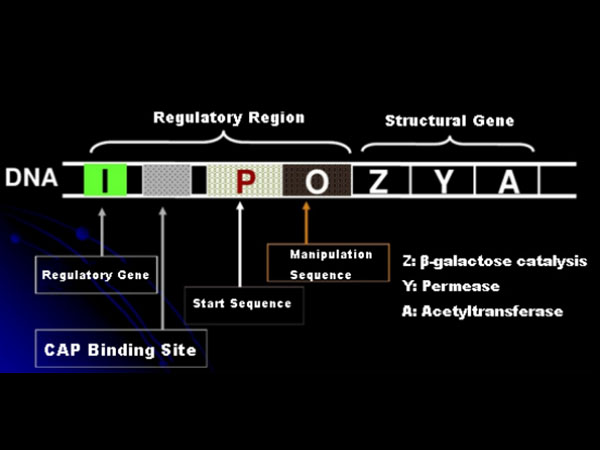
În primul rând, să înțelegem principiul inducției IPTG: operonul (elementul) de lactoză al lui E. coli conține trei gene structurale, Z, Y și A, care codifică β-galactozidază, permează și, respectiv, acetiltransferaza.lacZ hidrolizează lactoza în glucoză şi galactoză sau în alo-lactoză;lacY permite lactozei din mediu să treacă prin membrana celulară și să intre în celulă;lacA transferă gruparea acetil de la acetil-CoA la β-galactozidă, ceea ce implică eliminarea efectului toxic.În plus, există o secvență operațională O, o secvență inițială P și o genă reglatoare I. Codul genei I este o proteină represoare care se poate lega la poziția O a secvenței operatorului, astfel încât operonul (meta) este reprimat și oprit.Există, de asemenea, un situs de legare pentru situsul de legare proteină-CAP activator al genei catabolice în amonte de secvența de inițiere P. Secvența P, secvența O și situsul de legare CAP constituie împreună regiunea reglatoare a operonului lac.Genele de codificare ale celor trei enzime sunt reglate de aceeași regiune de reglare pentru a obține expresia coordonată a produselor genetice.
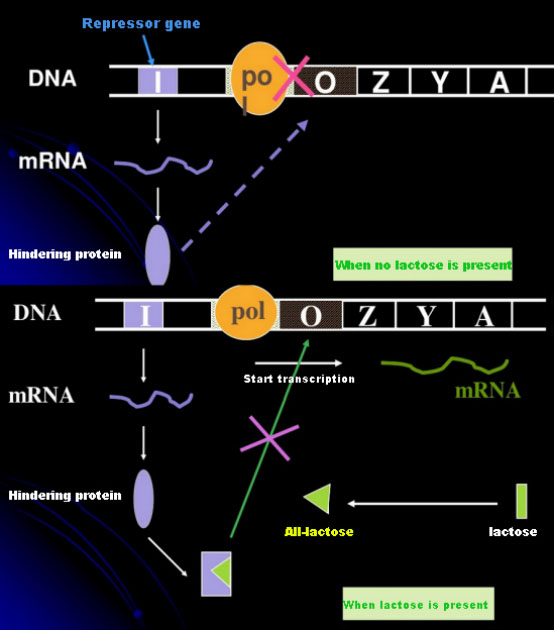
În absența lactozei, operonul lac (meta) se află într-o stare de represiune.În acest moment, represorul lac exprimat de secvența I sub controlul secvenței promotorului PI se leagă de secvența O, ceea ce împiedică ARN polimeraza să se lege de secvența P și inhibă inițierea transcripției;când lactoza este prezentă, operonul lac (meta) poate fi indus În acest sistem de operon (meta), inductorul real nu este lactoza în sine.Lactoza intră în celulă și este catalizată de β-galactozidază pentru a fi transformată în alolactoză.Acesta din urmă, ca moleculă inductoare, se leagă de proteina represoare și modifică conformația proteinei, ceea ce duce la disocierea proteinei represoare de secvența O și transcripție.Izopropiltiogalactozida (IPTG) are același efect ca alolactoza.Este un inductor foarte puternic, care nu este metabolizat de bacterii și este foarte stabil, deci este utilizat pe scară largă în laboratoare.
Cum se determină concentrația optimă de IPTG?Luați ca exemplu E. coli.
Tulpina de E. coli BL21 modificată genetic care conține pGEX recombinant pozitiv (CGRP/msCT) a fost inoculată în mediu lichid LB care conține 50μg·mL-1 Amp și cultivată peste noapte la 37°C.Cultura de mai sus a fost inoculată în 10 sticle de 50 ml mediu lichid LB proaspăt care conține 50 μg·mL-1 Amp la un raport de 1:100 pentru cultura de expansiune, iar când valoarea OD600 a fost 0,6~0,8, IPTG a fost adăugat la concentrația finală.Este 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0 mmol·L-1.După inducție la aceeași temperatură și în același timp, s-a prelevat din acesta 1 mL de soluție bacteriană, iar celulele bacteriene au fost colectate prin centrifugare și supuse SDS-PAGE pentru a analiza influența diferitelor concentrații de IPTG asupra expresiei proteinei, iar apoi selectați concentrația IPTG cu cea mai mare expresie a proteinei.
În urma experimentelor, se va constata că concentrația de IPTG nu este cât se poate de mare.Acest lucru se datorează faptului că IPTG are o anumită toxicitate pentru bacterii.Depășirea concentrației va ucide și celula;și, în general, sperăm că cu cât proteina este mai solubilă exprimată în celulă, cu atât mai bine, dar în multe cazuri când concentrația de IPTG este prea mare, se va forma o cantitate mare de incluziune.Corp, dar cantitatea de proteine solubile a scăzut.Prin urmare, cea mai potrivită concentrație de IPTG nu este adesea cu cât este mai mare, cu atât mai bine, ci cu cât concentrația este mai mică.
Scopul inducerii și cultivării tulpinilor modificate genetic este de a crește randamentul proteinei țintă și de a reduce costurile.Expresia genei țintă nu este afectată numai de factorii proprii ai tulpinii și de plasmida de expresie, ci și de alte condiții externe, cum ar fi concentrația inductorului, temperatura de inducție și timpul de inducție.Prin urmare, în general, înainte ca o proteină necunoscută să fie exprimată și purificată, cel mai bine este să se studieze timpul de inducție, temperatura și concentrația IPTG pentru a selecta condițiile adecvate și a obține cele mai bune rezultate experimentale.
Ora postării: 31-dec-2021

